近日,威尼斯官网郑越副教授等在氨氧化微生物(Ammonia-oxidizing microorganisms,AOM)生态生理学领域取得新进展,综合利用稳定性同位素示踪、NanoSIMS、反应动力学、转录组等技术,研究破译了目前已知的全球共四个主要谱系的AOM(包括氨氧化古菌、β-变形菌门氨氧化细菌、γ-变形菌门氨氧化细菌、全程硝化细菌)对两种典型氮素底物(氨和尿素)的代谢偏好性选择策略及其调控机制,揭示了不同谱系AOM的底物偏好和调节系统的多样性。相关成果以Ammonia-oxidizing bacteria and archaea exhibit differential nitrogen source preferences为题发表在Nature Microbiology上。
研究背景
氨氧化微生物(Ammonia-oxidizing microorganisms,AOM)以氨氮作为能源和氮源,每年驱动了全球约23亿吨氨的氧化过程,是生物地球化学循环中氮元素源汇联通的关键纽带,对全球氮循环意义重大。微生物如何适应环境是环境微生物的经典科学问题。自1890年Sergei Winogradsky分离得到第一株AOM,氨氧化微生物的环境适应性研究开启了生态生理学的新纪元。百余年的研究中,从生态学的角度,不同AOM谱系的发现(Könneke et al., Nature 437: 543, 2005;Daims et al., Nature 528: 504, 2015)拓展了多阶生态位下AOM生物地理学的理论体系。从生理学的角度,不同谱系AOM对氨氮底物亲和力差异是解释其生态位竞争适应性的基础假说(Martens-Habbena et al., Nature 461: 976, 2009;Kits et al., Nature 549: 269, 2017)。在实际环境中,不同谱系AOM杂居混存。然而,传统AOM生物地理学理论体系和AOM底物亲和力差异假说均无法阐明不同谱系AOM在复杂生态位下共存的核心难题。
该难题的本质是:传统AOM生态生理学研究仅能描述多物种对单一底物的简单代谢策略,无法解构实际环境中多物种对多底物的复杂代谢网络。诺贝尔医学生理学奖得主Jacques Lucien Monod揭示了大肠杆菌如何通过巧妙地碳代谢抑制(carbon catabolite repression)调控机制来顺序使用不同碳源,这一过程已成为教科书中的经典基因调控案例。然而,对于氮源,尤其当氮作为能源物质时,微生物是如何通过调控自身基因表达适应环境中不同氮源情况的机制,迄今并不清楚。该科学问题是解析不同谱系AOM生态位竞争和共存的关键,也是厘清AOM复杂氮代谢网络的突破口。
研究成果
研究发现,与氨合成过程一样,氨氧化也需要将氨转运到细胞内才能进行能量代谢。这一发现颠覆了以往对现有微生物氨氧化过程生化模型的认知。另外,研究发现AOM对氨的亲和力并非是一个不变的常数,而是一种可根据环境中氨的缺乏度适应性调节的变量。这对如何用生物地球化学模型模拟AOM群体对氨氮资源的竞争以及氮素转化的过程有重要指导意义。
同时,研究指出不同谱系的AOM对不同氮源有着截然不同的代谢偏好,从而可以很好地避免对单一氨氮的直接竞争。其中,β-氨氧化细菌偏好使用尿素而非氨,并对尿素有更高的亲和力,在有尿素的情况下会抑制氨氮的使用。这一惊人发现挑战了130年来研究领域对于尿素只作为次优或代替氮源的普遍认知。这对理解同一环境中不同谱系AOM的生态适应策略和共存机制,以及模拟全球硝化过程中氮素分流的微生物学机制都具有极其重要的意义。
① 不同AOM谱系表现出氮源能量代谢偏好性差异
本研究基于AOM的比较基因组分析发现,七个不同种类的AOM物种中均存在着编码氨氮代谢和尿素代谢的相关基因,这表明这些物种具备利用氨氮和尿素的潜力。研究选择了七个代表性的菌株进行氮源能量代谢偏好性实验。七个代表性的菌株包括一株海洋氨氧化古菌(ammonia-oxidizing archaea,AOA;Nitrosopumilus piranensis D3C)、一株土壤AOA(Nitrososphaera viennensis EN76)、三株β-氨氧化细菌(ammonia-oxidizing bacteria,AOB;Nitrosospira lacus APG3、Nitrosospira multiformis ATCC 25196和Nitrosomonas ureae Nm10)、一株海洋γ-AOB(Nitrosococcus oceani ATCC 19707)以及一株全程硝化细菌(complete ammonia oxidizer,comammox;Nitrospira iinopanta ENR4)。本研究分别进行了仅含氨、仅含尿素以及氨和尿素等量混合的培养实验。在氨和尿素等量混合的培养实验中,使用了分别以仅含氨和仅含尿素作为底物的培养液作为接种液。在混合底物的培养基中生长时,实验结果展现出三种明显不同的氮利用模式:AOA和comammox在消耗掉氨之后才开始水解尿素(图1a–c);而β-AOB则在消耗掉尿素之后才开始大量消耗游离态的氨(图1d–f)。相比之下,γ-AOB对氨和尿素的利用没有明显偏好性(图1g)。值得注意的是,无论各培养物(接种液)是来自仅含氨还是仅含尿素的预生长培养液,都得到了相同的结果。具体而言,海洋AOA在氨消耗尽,转向使用尿素之前表现出明显的延滞期,这表明在消耗完氨后到开始利用尿素时需要更长的适应性转变(图1a);而土壤AOA在转变期并没有明显的滞后(图1b)。然而,comammox则在氨耗尽之前就开始消耗尿素,没有表现出严格的底物二元转变(图1c)。对于β-AOB,在尿素被利用期间,N. lacus 和N. multiformis中游离态的氨存在一定程度的升高;而N. ureae中游离态氨略有下降。不过,这三株β-AOB都只有在尿素基本全部耗尽后才开始大量利用氨(图1d–f)。本研究进一步考察了各AOM在不同底物环境中的特异比生长速率。类似地,本研究发现AOA和comammox在选择性利用氨时相较于选择性利用尿素表现出明显更高的特异比生长速率(图1a–c)。相反,β-AOB在选择性利用尿素时与选择性利用氨时相比,特异比生长速率相当或者更高(图1d–f)。
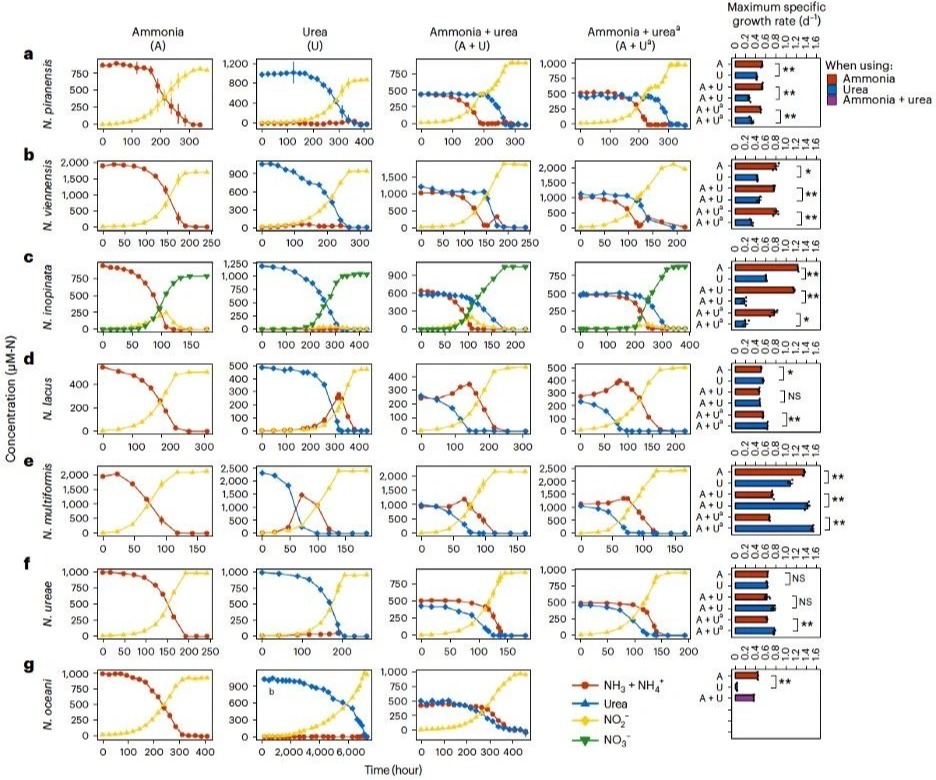
图1 不同底物组合下AOM的生长曲线和最大生长速率(μmax)
为进一步评估在尿素存在时对游离态氨的使用情况,并探究替代氮源的转化过程,本研究选择以释放大量游离态氨的N. lacus作为研究对象。通过采用15N稳定同位素示踪方法,追踪了N. lacus在批式培养过程中对氨和尿素的利用情况。根据随时间推移胞外15N同位素的积累情况,将其分为三个不同阶段(图2)。在加入15NH3和14N-尿素的培养组中,发现在延滞期(0–50小时)阶段,少量15NO2-的产生主要来源于15NH3,这可能是由于接种液是来自以氨作为底物的培养基进行的预培养。然而,当N. lacus生长进入指数期(到100–150小时),本研究发现在整个指数生长过程中,最初产生的少量15NO2-被源自尿素产生的未标记NO2-迅速稀释。换句话说,15NH3对15NO2-产量的贡献急剧下降(图2a)。相反,在加入15N-尿素和14NH3的培养组中,结果表明:在指数生长过程中,NO2-的积累几乎完全源自尿素(图2b)。进入第三阶段,即当尿素耗尽后(~150小时),氨消耗迅速恢复,且直到停止生长,所有NO2-的积累都来自氨(图2a)。
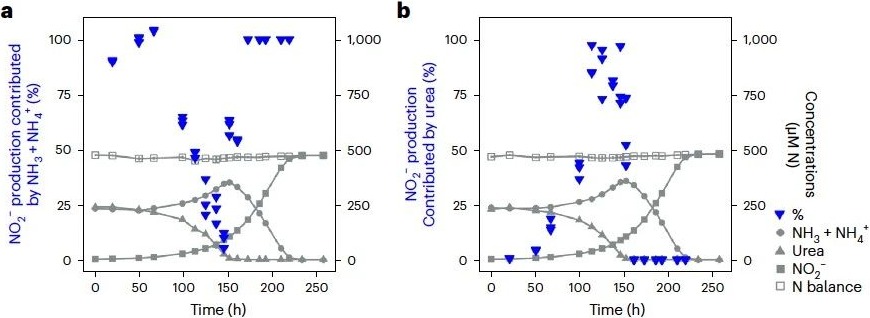
图2 利用15N稳定同位素示踪方法追踪N. lacus对氨和尿素的利用情况
② 合成代谢对不同氮源的利用也具有偏好
由于氨和尿素不仅会被AOM氧化进行能量代谢,还会被吸收用于合成代谢,因此本研究利用稳定同位素标记结合纳米二次离子质谱(Nano Secondary Ion Mass Spectrometry,NanoSIMS),在单细胞水平上检测它们在不同种AOM中的合成情况。本研究分别在各AOM利用偏好的氮源时(T1)以及所有氮源被耗尽时(T2)采集样本。由于N. oceani同时氧化两种底物,因此分别在指数后期(T1)和两种底物被消耗殆尽时(T2)进行样本采集。首先,在T1时,β-AOB N. lacus新合成的氮有83.9 ± 6.9%来自尿素,而只有16.1 ± 1.4%来自氨;而在T2时,新合成的氮则只有54.2 ± 2.5%来自尿素,而来自氨的合成量增加到了45.8 ± 1.9%(图3b和c)。因此,即使在培养基中存在游离态氨,N. lacus仍然优先利用尿素中的氮,在尿素中的氮耗尽后才明显开始吸收氨中的氮。T1阶段对氨氮的少量吸收,可能是因为接种液源自仅含氨的培养基。此外,本研究还对海洋AOA、土壤AOA和comammox进行了相同实验。他们与N. lacus表现出截然相反的吸收偏好性,都表现为优先吸收氨。而γ-AOB对氨和尿素则没有表现出明显的吸收偏好性。
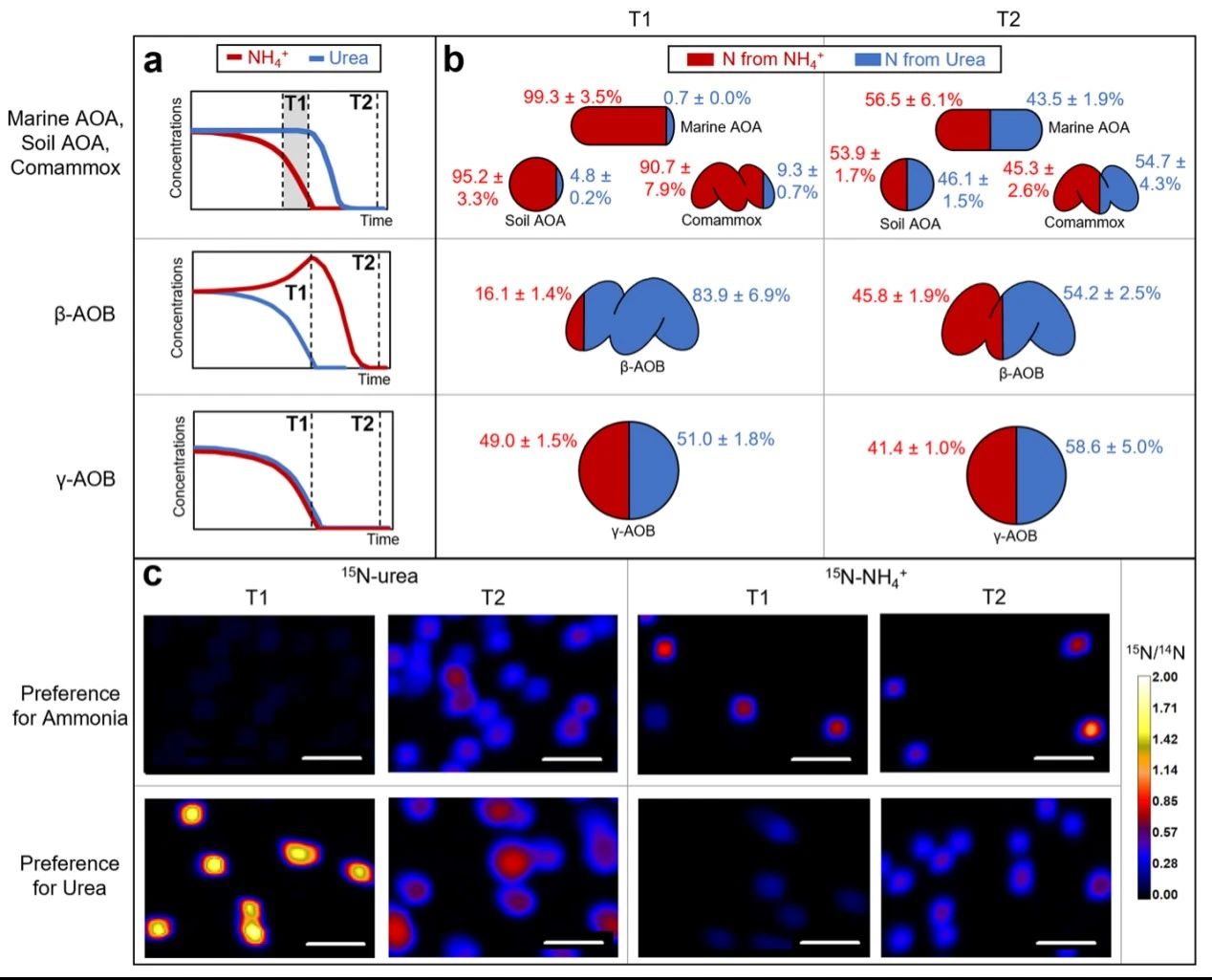
图3 基于NanoSIMS分析氮吸收特征
③ 氨和尿素氧化的动力学特征
为确定AOM对不同氮源的偏好是否与不同的细胞动力学相关,本研究使用微呼吸测量法表征了氨和尿素依赖性的氧化动力学特征。结果表明,海洋AOA对氨和尿素表现出相似的半饱和常数(Km(app)),分别为0.70 ± 0.22 µM 和 1.65 ± 0.82 µM。土壤AOA对氨的Km(app))与海洋AOA相当,为0.68 ± 0.16 µM;然而,对尿素的Km(app))则明显更高,为8.97 ± 1.27 µM(图4a)。因此,它们对氨和尿素的特异性亲和力与其对这两种氮源的偏好性一致(图4b)。
对于comammox,与AOA的结果类似,comammox对氨也具有较高的亲和力。然而,与AOA不同的是,comammox对尿素也同样具有非常高的亲和力,分别超过了海洋和土壤AOA的20倍和90倍(图4a和b)。comammox对尿素极高的亲和力可能源于其拥有的高效ATP依赖型尿素转运系统。
值得注意的是,β-AOB中的N. lacus和N. multiformis对尿素的亲和力比对氨高出了2.7–6.2倍。相比于土壤AOA对尿素的亲和力,它们具有相当或者甚至更高的亲和力,这也意味着在土壤和淡水沉积物环境中,一些常见的AOB可能会有效地与AOA竞争尿素。
此外,本研究还进一步检测了在以尿素为底物的培养基中生长的AOA和comammox对氨的亲和力。令人惊讶的是,只有土壤AOA表现出与之前在以氨为底物的培养基中生长时相似的亲和力,这表明其细胞氨氧化动力学不受培养基中的氮源种类的影响。而在以尿素为底物生长的海洋AOA和comammox细胞中,它们对氨的亲和力显著高于以氨为底物生长的细胞。这表明,海洋AOA和comammox更适应利用氨氮作为主要偏好氮源。
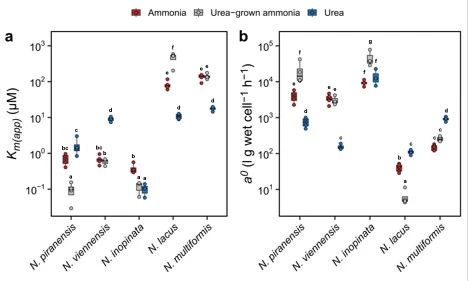
图4 氨和尿素作为氧化底物的米氏动力学常数
④ 从转录角度探讨AOM在单一和混合氮源条件下生长的响应
为进一步了解不同AOM对于氮源选择的调控机制,首先使用单一氮源培养AOM菌种,随后研究在对数生长期引入替代氮源后,AOM的氨氮和尿素代谢相关基因在转录水平上的变化。研究发现,在海洋AOA和土壤AOA中,无论在任何初始氮源条件下培养,amoA(ammonia monooxygenase alpha subunit)、gdh(glutamate dehydrogenase)和gs(glutamine synthetase)基因的转录水平都没有表现出明显不同。相反,amt1(putative high-affinity ammonium transporter)、ut(urea transporter)、ure(urease)和glnB(PII protein)基因,它们的转录水平对添加替代氮源表现出高度敏感(图5a和b)。具体而言,海洋AOA只在使用尿素的时候才会大量转录尿素转运和水解相关的基因,而在使用氨的时候,这些基因的转录水平都很低。与此同时,在海洋AOA菌种中,高亲和力的氨转运amt1基因在所有培养条件和生长阶段均呈现出较高水平的转录,值得注意的是,在以尿素为底物进行生长时,其转录水平明显高于以氨为底物的水平(图5a,UA-T1相较于AU-T1)。这一差异与我们动力学分析的结果一致(图4),强调了在尿素环境中生长的海洋AOA细胞对氨表现出更强的特异性亲和力。
其次,与AOA不同,comammox对尿素的消耗不如AOA严苛,主要表现为,在含氨的培养液中添加尿素后,comammox会立即进行尿素水解(图5c)。此外,在氨消耗尽,转向利用尿素进入指数生长阶段时,comammox的amt基因的转录水平明显增加(图5c,AU-T3相较于AU-T1)。相反,在向尿素生长的细胞中加入氨后,amt基因的转录丰度则显著降低(图5c,UA-T2相较于UA-T1)。与在以氨为底物的培养基中的生长相比(图5c,AU-T1),comammox在以尿素为底物的培养基中生长时amt基因的转录水平更高(图5c,UA-T1)。这与在尿素中预培养的comammox细胞对氨有更高亲和力的结果一致(图4)。与此同时,与海洋AOA不同,comammox的urt和ure基因不仅在尿素培养液的指数生长期具有较高的转录水平(图5c,UA-T3相较于UA-T1),而且在氨中生长时也维持了不低的转录水平。
基于之前的分析,研究团队已经明确了解到β-AOB中的N. lacus在摄取尿素时会释放大量游离态的氨。据此,研究团队同时添加了等量的氨氮和尿素氮,并在N. lacus利用尿素及尿素耗尽后转而利用氨氮的各个阶段,分别收集细胞进行转录组分析。研究发现无论在细胞利用氨氮还是尿素氮阶段,所有参与尿素吸收和水解的相关基因都表现出相对较高的转录水平(图5d)。这表明这些基因在N. lacus中是组成型表达,在其生长过程中,细胞会分配大量资源以促进对尿素的优先利用。
相比之下,由于γ-AOB N. oceani对于氨氮和尿素使用没有明显偏好,当尿素被加到以氨为氮源的菌液中时,细胞立刻开始水解尿素。同时,在添加替代氮源前后,所有氮代谢相关基因的转录水平并未显示出明显变化(图5e)。
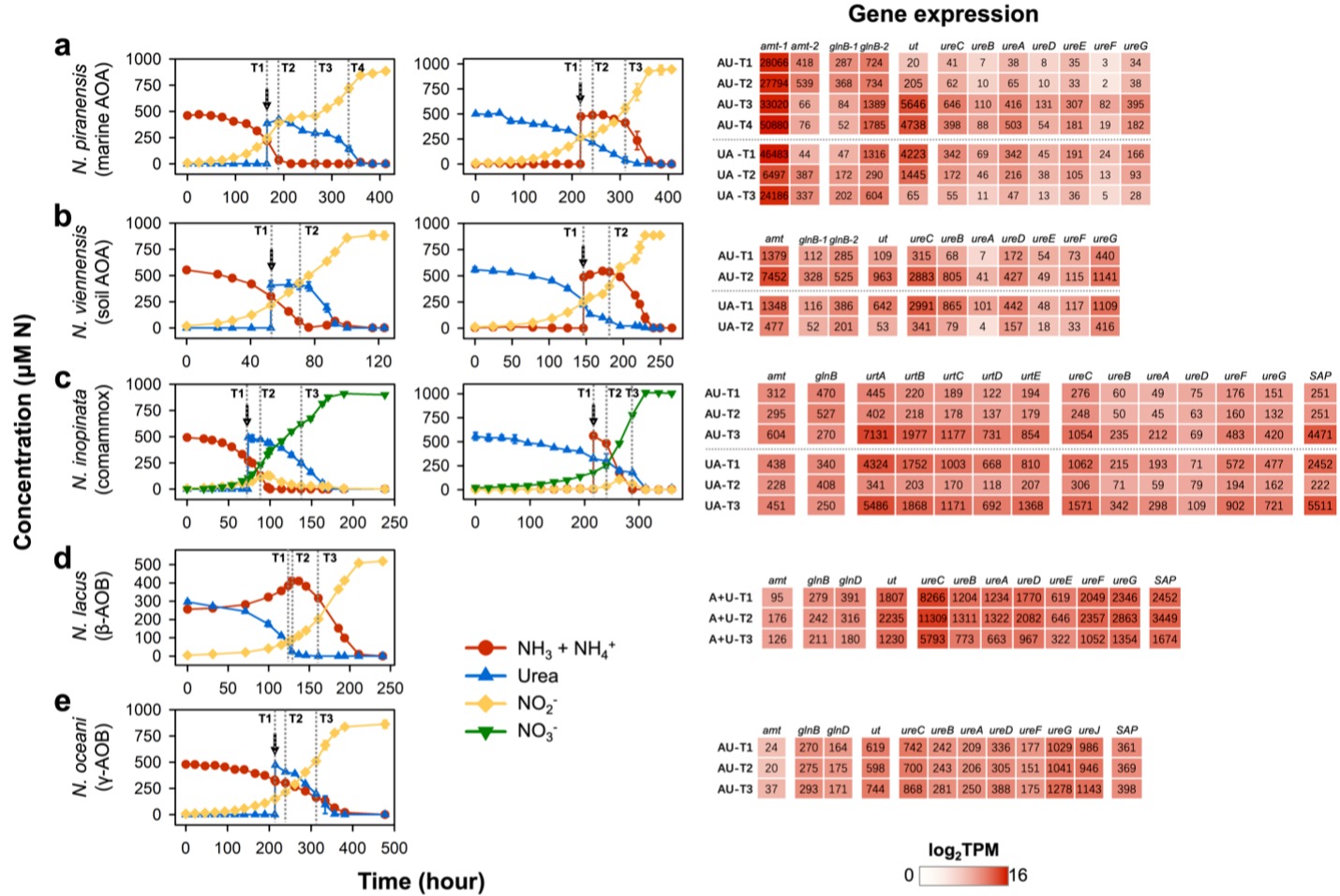
图5 不同种AOM从单一氮源转变为氨-尿素混合氮源培养时的转录响应
研究团队
该论文第一及通讯作者为俄克拉荷马大学的秦玮教授,华盛顿大学的Stephany P. Wei博士后、威尼斯官网郑越副教授和佛罗里达大学的Eunkyung Choi博士后为共同第一作者,华盛顿大学的Mari-Karoliina H. Winkler教授和佛罗里达大学的Willm Martens-Habbena教授为共同通讯作者。稳定性同位素示踪研究由普林斯顿大学的万显会博士后(现38238a威尼斯欢迎你教授)完成。此外,还有国内外多位资深科学家参与合作,包括耶鲁大学的孙欣博士后,南京农业大学的王保战教授和蒋建东教授、中国科学院南京土壤研究所的颜晓元研究员、38238a威尼斯欢迎你的张瑶教授和王大志教授、俄克拉荷马大学的周集中教授和潘崇乐教授、华盛顿大学的David A. Stahl教授、普林斯顿大学的Bess B. Ward教授和劳伦斯利弗莫尔国家实验室的Xavier Mayali教授。还有多位俄克拉荷马大学的科研人员参与了此项研究,包括李相鹏博士后、李含嫣博士后、陶庆博士生、Wyatt W. Chlouber研究生、Michael Wells博士后、Long Ngo技术员、陶玄宇博士后、王东彧博士生以及俄克拉荷马大学与38238a威尼斯欢迎你联合培养的侯蕾博士后。
文、图 | 侯蕾
责任编辑 | 郑越
排版 | 吴晓倩

