近日,威尼斯官网叶从庭副教授与中山大学姚成果副教授合作,在真核基因转录调控领域取得新进展,相关成果以“U4 snRNP inhibits premature cleavage and polyadenylation of pre-mRNAs”为题发表在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)。

研究背景
在生化教科书中,U4 snRNP与U1 snRNP的经典功能是参与真核细胞内pre-mRNA剪接(pre-mRNA splicing)。2010年,美国University of Pennsylvania的Dreyfuss实验室发现U1 snRNP具有维持全长mRNA转录完整性的新分子生物学功能(2010, Nature)。他们基于使用针对U1 snRNA的AMO (antisense morpholino oligonucleotide)发现HeLa细胞受到U1 AMO处理后,数千个基因的内含子区域发生了提前的mRNA 3’末端加工(剪切和加尾),即mRNA PCPA(premature cleavage and polyadenylation)现象。PCPA使得mRNA的长度变短。随后在2012年和2017年,他们团队继续在Cell和NSMB杂志发表论文,揭示这一现象在真核细胞中普遍存在,并命名为U1 telescripting,以区别于U1 splicing功能。但在分子机制的研究上,有一个困惑共转录加工分子机制研究领域的问题是,U1的这一现象究竟是否与U1的splicing功能相关并不清楚。尽管Dreyfuss等认为U1 telescripting独立于U1 splicing功能(2019, Mol Cell),但证据并不充分。2023年,中山大学姚成果副教授与威尼斯官网叶从庭副教授合作,在JBC上报道U1 AMO可以破坏U1 snRNP的结构(2023, JBC),从而直接挑战了Dreyfuss等的U1-CPAF复合体参与U1 telescripting的分子机制模型 (2019, Mol Cell)。在理论上,pre-mRNA splicing可以去除数以万计的内含子内cryptic PAS (polyadenylation site)顺式元件,有可能是U1的splicing功能直接参与了U1 telescripting功能。
研究结果
为了进一步验证上述猜想,团队针对U4 snRNP (splicing过程中的另一核心复合体)设计了U4 AMO。在HeLa细胞中,In-situ hybridization和In vitro splicing实验证明了U4 AMO特异性的针对U4 snRNA并失活了U4 snRNP。mRNA 3’-Seq实验发现,U4 AMO同U1 AMO一样,可以在转录组规模激活内含子内上万cryptic PAS的利用(>4000基因),且影响了超过5000个基因的mRNA APA (alternative polyadenylation)。随后发现这一现象在其它细胞系(HEK293、 SW480、NIH3T3、Neuro-2a)中具有普遍性。进一步针对RNAPII的ChIP-seq实验表明,U4 AMO处理使得RNAPII转录在转录组规模发生了变化,这与转录组规模的PCPA现象相符。但U4转录调控与PCPA抑制的因果关系尚待进一步研究。
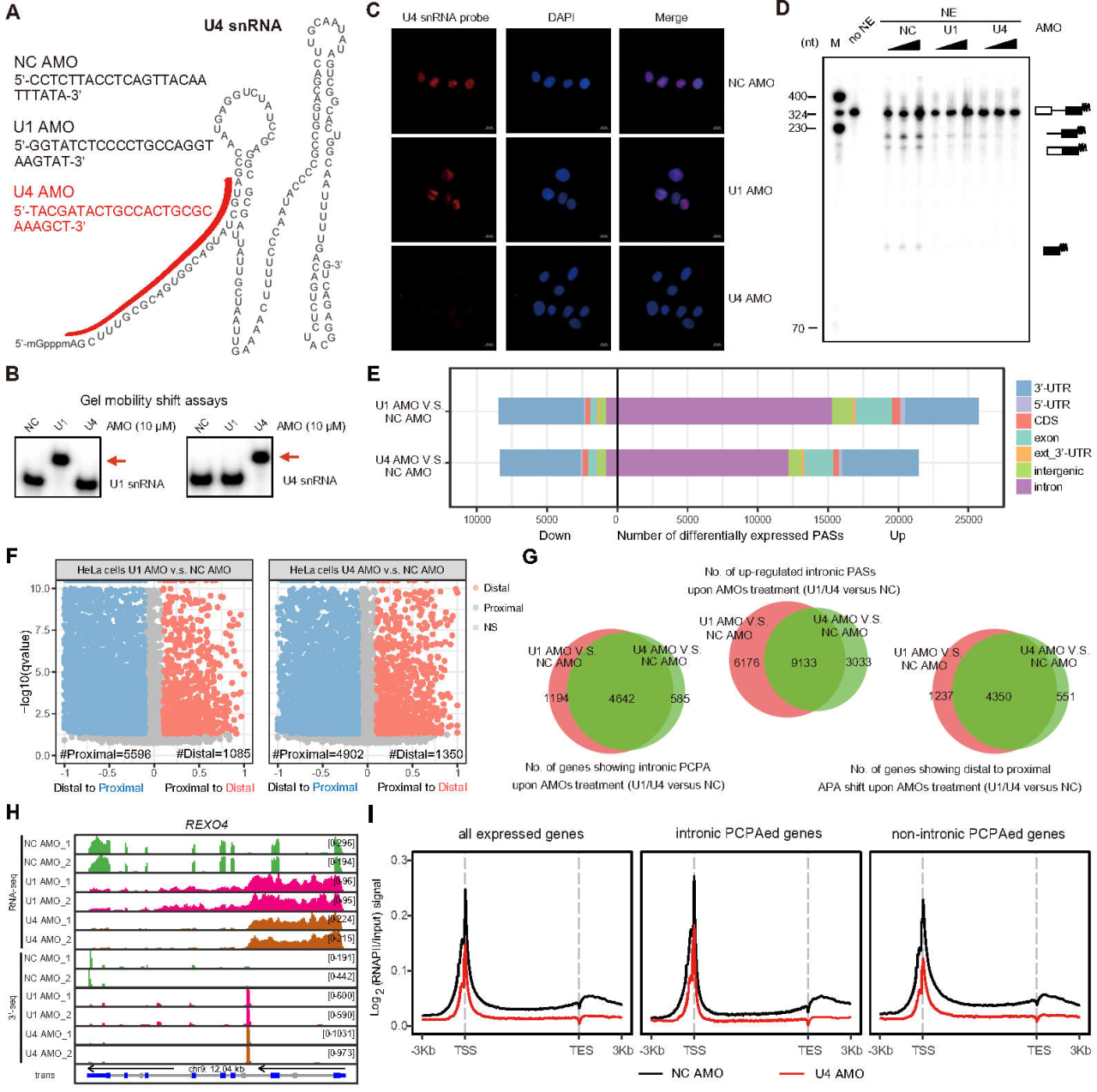
图1. 通过U4 AMO抑制U4 snRNP在转录组规模激活PCPA
这项研究首次用高精度的直接的mRNA 3’-seq证据(而不是传统的microarray或mRNA-seq方法)表明,以U1、U4为代表的参与splicing过程的核心pre-mRNA剪接体复合物,很有可能通过splicing过程抑制了内含子内数以万计的cryptic PAS的使用,从而维持全长mRNA的转录完整性。这个假说有望为分子生物学中心法则下的真核基因表达调控增添新的内容:即splicing的另一普适性新功能,是防止基因转录提前PCPA,从而预防过早转录终止(premature transcription termination, PTT)。值得一提的是,该论文从提交到接受仅用41天,侧面表明编辑和审稿人对研究结果的高度认可。
研究团队及资助
中山大学研究生冯秋敏和威尼斯官网研究生赵丹慧、林泽瑾是论文的共同第一作者,威尼斯官网叶从庭副教授与中山大学姚成果副教授是论文的共同通讯作者。该研究得到了包括国家重点研发计划项目、国家自然科学基金面上项目、福建省自然科学基金面上项目和广东省自然科学基金面上项目等多项基金的资助。
参考文献
1. Kaida D, Berg MG, Younis I, Kasim M, Singh LN, Wan L, Dreyfuss G. U1 snRNP protects pre-mRNAs from premature cleavage and polyadenylation. Nature. 2010 Dec 2;468(7324):664-8.
2. Berg MG, Singh LN, Younis I, Liu Q, Pinto AM, Kaida D, Zhang Z, Cho S, Sherrill-Mix S, Wan L, Dreyfuss G. U1 snRNP determines mRNA length and regulates isoform expression. Cell. 2012 Jul 6;150(1):53-64.
3. Oh JM, Di C, Venters CC, Guo J, Arai C, So BR, Pinto AM, Zhang Z, Wan L, Younis I, Dreyfuss G. U1 snRNP telescripting regulates a size-function-stratified human genome. Nat Struct Mol Biol. 2017 Nov;24(11):993-999.
4. So BR, Di C, Cai Z, Venters CC, Guo J, Oh JM, Arai C, Dreyfuss G. A Complex of U1 snRNP with Cleavage and Polyadenylation Factors Controls Telescripting, Regulating mRNA Transcription in Human Cells. Mol Cell. 2019 Nov 21;76(4):590-599.e4.
5. Feng Q, Lin Z, Deng Y, Ran Y, Yu R, Xiang AP, Ye C, Yao C. The U1 antisense morpholino oligonucleotide (AMO) disrupts U1 snRNP structure to promote intronic PCPA modification of pre-mRNAs. J Biol Chem. 2023 Jul;299(7):104854.
6. Feng Q, Zhao D, Lin Z, Li M, Xiang AP, Ye C, Yao C. U4 snRNP inhibits premature cleavage and polyadenylation of pre-mRNAs. Proc Natl Acad Sci U S A. 2024 Jul 2;121(27):e2406710121.
文、图 | 叶从庭
排版 | 吴晓倩

